Depuis la fabuleuse découverte de la double hélice de l’ADN en 1953, les chercheurs ont appris à lire, à recopier et même à fabriquer et recombiner des morceaux d’ADN. La synthèse de l’ADN et l’assemblage des gènes sont-elles des technologies suffisamment sûres et à l’épreuve de tous les risques ? Quel est le potentiel de la génomique synthétique et quels sont ses défis ?
Il y a 70 ans, le 25 avril 1953, trois articles publiés dans la revue Nature ont changé notre vision du monde. La découverte de la structure de la molécule origine de l’hérédité, l’ADN en double hélice, représente l’une des plus grandes découvertes en biologie du XXe siècle.
L’organisation de la molécule siège de la vie est somme toute assez simple : l’ADN est constitué d’unités répétitives, les nucléotides, qui forment une chaîne chimique. Un nucléotide est une molécule issue de la combinaison de trois composants chimiques : une base azotée, un sucre et de l’acide phosphorique. Quatre types de bases azotées déterminent quatre types de nucléotides, qui se combinent à l’infini dans l’ADN et sont à la base de la diversité du vivant (A : adénosine ; T : thymine ; G : guanine ; C : cytosine). Enfin, dans l’ADN, chaque nucléotide est lié à ses deux voisins par une liaison chimique dite « phosphodiester ». Dans le vivant, ce sont des enzymes, catalyseurs des réactions biochimiques, qui réalisent ces liaisons chimiques.

À LA MANIÈRE D’HENRI MATISSE… LA DOUBLE HÉLICE D’ADN A ÉTÉ DÉCOUVERTE EN 1953, IL Y A 70 ANS. QU’EN A-T-ON TIRÉ DEPUIS ?
Depuis que cette structure a été élucidée, les humains ont appris à lire l’ADN de plus en plus vite et des brins de plus en plus longs. Parallèlement, nous avons trouvé comment fabriquer (synthétiser) de l’ADN à partir de bases azotées (1972) – ce qui nous permet aujourd’hui d’aller jusqu’à inventer des ADN comme un écrivain invente un livre à partir de l’alphabet (en respectant quelques règles de grammaire tout de même).
Nous savons également « amplifier » de l’ADN (1983), c’est-à-dire cibler une région bien déterminée sur l’ADN et la recopier en milliers d’exemplaires, notamment avec la désormais bien connue PCR. Et bien sûr, nous savons éditer le génome (à partir de 1973 grâce à l’« ADN recombinant », où on combine différents morceaux d’ADN), c’est-à-dire le modifier localement pour en modifier ses fonctions – la technique d’édition du génome la plus connue est désormais celle des « ciseaux moléculaires » CRISPR-Cas9, né en 2012.
Ainsi, depuis 70 ans, l’amélioration des techniques de lecture de l’ADN, puis de fabrication et d’édition, ont conduit à développer notre capacité à comprendre le vivant.
Pourquoi fabriquer de l’ADN alors qu’il y en a partout dans la nature ?
Les synthèses à grande échelle et à faible coût sont sources de progrès tant en recherche fondamentale qu’appliquée. Par exemple, la reconstruction de génomes viraux, c’est-à-dire la re-création en laboratoire de génomes viraux identiques — virus de la grippe espagnole, VIH, SARS-CoV-2 par exemple — ont permis des avancées spectaculaires, comme l’accélération de la production de vaccins ou la génération de cellules résistantes aux infections liées à ces virus (tomates résistantes aux potyvirus par exemple).
Désormais, nous savons même écrire et concevoir de l’information génétique en nous inspirant du génome naturel, pour le reproduire en partie sur des régions intéressantes, ou bien dans sa globalité en l’optimisant.
Ceci est possible grâce à des progrès technologiques récents, comme les « puces à ADN », microdispositifs permettant de manipuler simultanément plusieurs séquences d’ADN, ou encore les technologies microfluidiques.
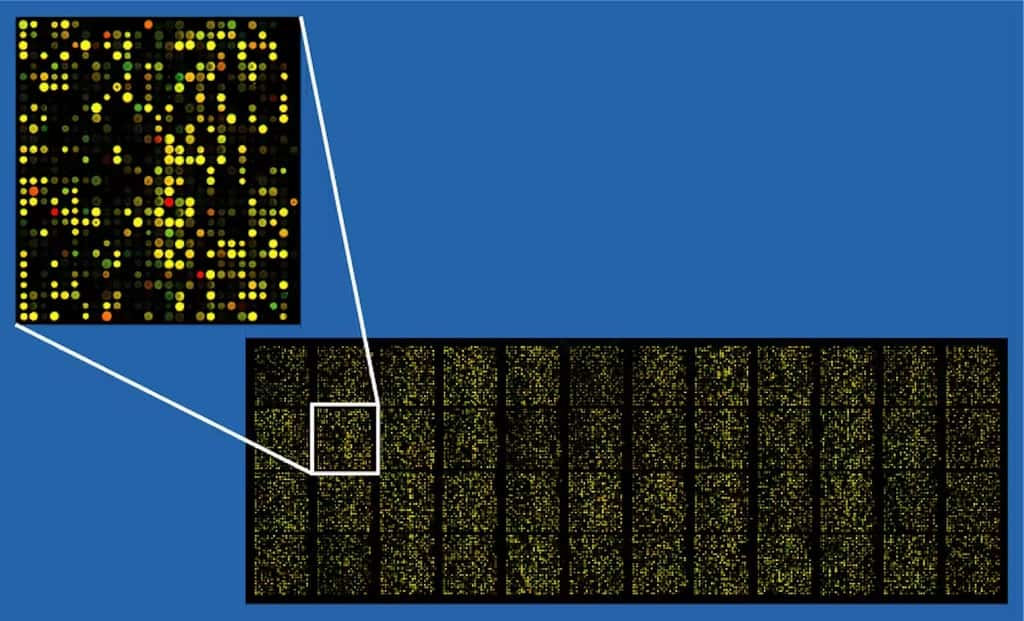
UNE PUCE À ADN AVEC 37 500 TESTS (ET UN ZOOM), PERMETTANT D’ANALYSER DE GRANDES QUANTITÉS DE DONNÉES.
Faire avancer la recherche et la médecine
La synthèse de génomes permet d’aborder des questions de recherche ouvertes et accélère les avancées dans un large éventail de domaines. Par exemple, il est désormais possible de construire une super cellule immunologique en programmant sa séquence d’ADN. C’est le cas des cellules CAR-T (chimeric antigenic receptor-T), des lymphocytes T modifiés génétiquement en 2012 dans le but de détecter et d’éliminer les cellules cancéreuses. D’autres champs d’applications consistent à produire des gènes non défectueux pour la thérapie génique, ou encore à développer un génome minimal avec les gènes essentiels pour aborder les principes de base de la vie, explorer la conception du génome entier et l’ingénierie métabolique.
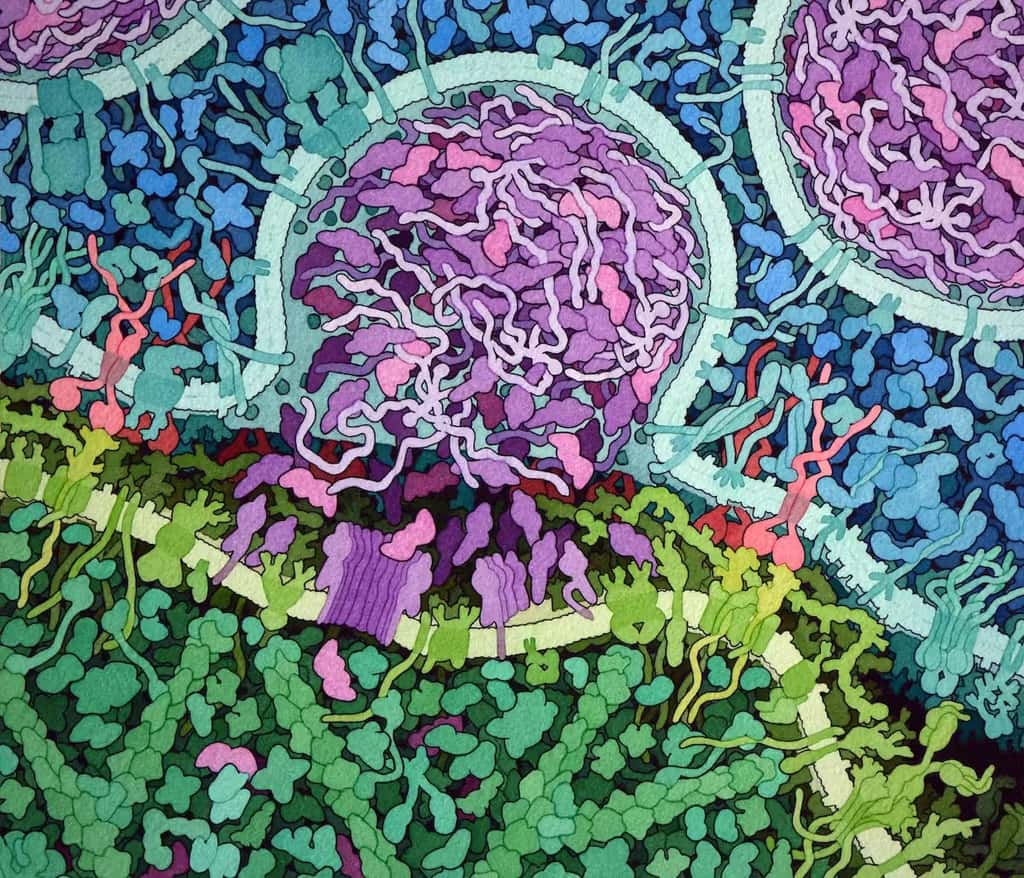
ILLUSTRATION D’UN LYMPHOCYTE T MODIFIÉ GÉNÉTIQUEMENT (EN BLEU) RECONNAISSANT ET ATTAQUANT UNE CELLULE LEUCÉMIQUE (EN VERT). LA MOLÉCULE CAR (EN ROUGE) S’ACCROCHE À LA PROTÉINE CD19 QUE L’ON TROUVE À LA SURFACE DES CELLULES LEUCÉMIQUES. CECI ACTIVE LE LYMPHOCYTE T, QUI RELÂCHE DE LA PERFORINE (VIOLET), CE QUI REND LA MEMBRANE CELLULAIRE POREUSE ET LAISSE PÉNÉTRER DES MOLÉCULES CYTOTOXIQUES (GRANZYMES EN MAGENTA) QUI DÉCLENCHENT LA MORT CELLULAIRE.
Mais, malgré les améliorations continues des techniques de synthèse, les capacités de lecture de l’ADN restent aujourd’hui très supérieures aux capacités d’écriture (en termes de temps requis par échantillon, nombre d’échantillons étudiés en même temps, analyse des résultats et automatisation).
Ainsi, la synthèse de l’ADN figure parmi les étapes les plus contraignantes de l’étude du vivant, limitée par les taux d’erreur (qui augmentent avec la taille de l’ADN à synthétiser) et les difficultés d’assemblage des fragments pour la synthèse de génomes complets.
Comment a-t-on appris à synthétiser de l’ADN
À la suite de la découverte de la structure chimique de l’ADN, les chercheurs se sont intéressés à synthétiser de l’ADN au laboratoire : il s’agit de préparer les nucléotides à partir de leurs ingrédients, puis de les assembler.
La génomique synthétique est née avec le premier « dinucléotide » synthétisé au laboratoire en 1955. Ensuite, en 1963, H. Gobind Khorana et son équipe ont synthétisé un ADN bicaténaire beaucoup plus long de 77 « paires de bases » (les bases azotées vont par deux : une sur chaque brin de la double hélice).
Les techniques de synthèse se sont progressivement améliorées dans les décennies qui ont suivi, mais sont restées limitées en termes de longueur de chaîne, de qualité et de rendement, en raison de réactions instables qui généraient des séquences ramifiées, tronquées ou mutées, c’est-à-dire des molécules non conformes à la structure en double hélice, qui assure que l’ADN est fonctionnel.
Au début des années 80, un étudiant de Khorana, Marvin Caruthers, a introduit des réactifs plus efficaces, les phosphoramidites, et a ainsi révolutionné la synthèse de l’ADN. Cette synthèse comprend quatre étapes et aboutit à l’addition d’un seul nucléotide au brin d’ADN, qui croît en étant fixé à un support solide (du verre ou du polystyrène par exemple). Cette méthode a été encore améliorée grâce à différents supports, puis automatisée, ce qui a permis de réduire le temps de synthèse.
Comment fabrique-t-on aujourd’hui de l’ADN ?
Aujourd’hui, de nombreuses versions modifiées des phosphoramidites ont vu le jour, avec des propriétés optimisées pour des synthèses d’ADN spécifiques.
La chimie des phosphoramidites reste la méthode de référence pour la fabrication d’ADN, utilisée dans l’industrie depuis près de 40 ans avec une efficacité aujourd’hui supérieure à 99 % et une rapidité de synthèse de quelques minutes. Sa simplicité et sa haute efficacité permettent de synthétiser de grandes longueurs de séquences, jusqu’à 200 paires de bases, dont l’assemblage aboutit à la construction d’ADN encore plus grands, pour produire des gènes simples jusqu’à des génomes synthétiques entiers, tel que le génome de la levure de boulanger, Saccharomyces cerevisiae.
“Les capacités de synthèse de l’ADN disponibles aujourd’hui ont pris beaucoup de retard par rapport aux progrès réalisés dans le domaine du séquençage de l’ADN”
Si la chimie des phosphoramidites résiste à l’épreuve du temps, elle a des limites techniques. Par exemple, des erreurs peuvent se produire lors de synthèses successives résultant de réactions secondaires, comme des couplages incomplets, quand la liaison entre nucléotides complémentaires ne se produit pas, ou des incorporations erronées, par exemple un G au lieu d’un A.
Fabriquer de l’ADN, demain
Nous devons être conscients que les capacités de synthèse de l’ADN disponibles aujourd’hui ont pris beaucoup de retard par rapport aux progrès réalisés dans le domaine du séquençage de l’ADN. Les technologies actuelles de fabrication de l’ADN ne sont pas suffisamment mûres pour permettre l’ingénierie pratique et économique de génomes de grande taille.
Des efforts interdisciplinaires continus sont déployés pour utiliser de nouvelles chimies et stratégies pour synthétiser de l’ADN et assembler des gènes. De nouvelles stratégies inspirées des systèmes biologiques émergent mais pour l’instant, aucune technologie ne permet d’accéder à des séquences aussi grandes que celles trouvées dans la nature.
Les défis techniques actuels concernent l’assemblage de régions de la chaîne d’ADN qui sont hautement répétitives ou complexes. Quand ces verrous techniques seront surmontés, avec des stratégies de synthèse plus optimales, de nouvelles perspectives s’ouvriront pour résoudre les défis majeurs auxquels nous sommes confrontés en matière de ressources, d’énergie, de santé et d’environnement.
FUTURA