Plusieurs instituts de recherche publique français ont annoncé l’arrêt temporaire des recherches sur les prions après qu’un ancien agent de l’Inrae a développé les symptômes de la maladie de Creutzfeldt-Jakob.

[EN VIDÉO] Cerveau en 3D réalisé grâce à l’IRMa 3D En utilisant le nouveau logiciel d’IRMa 3D, une animation 3D peut être créée à partir d’une image IRM. Le détail frappant de ces mouvements amplifiés animés peut aider à identifier des anomalies, telles que celles causées par des blocages de fluides rachidiens, comprenant le sang et le liquide céphalorachidien dans le cerveau.
C’est une décision qui a été prise conjointement par l’Anses, le CEA, le CNRS, l’Inrae et l’Inserm, et appuyée par le ministère de l’Enseignement supérieur, de la recherche et de l’innovation. Les laboratoires français ont suspendu provisoirement – pour trois mois – la recherche sur les prions depuis le 27 juillet 2021.
Une mesure de précaution encouragée par la découverte d’un cas possible de la maladie de Creutzfeldt-Jakob chez un ancien chercheur de l’Inrae qui a travaillé sur les prions. Cette dégénérescence du cerveau peut avoir plusieurs origines : génétique, sporadique ou iatrogène, c’est-à-dire une infection via un instrument contaminé. La forme contractée par l’ancien chercheur n’est pas encore connue.
Ce n’est pas un cas unique. En 2019, une assistante-ingénieur est décédée de la maladie de Creutzfeldt-Jakob. Elle avait été infectée en 2010 à la suite d’une blessure lors d’une expérimentation. L’enquête menée après cet incident a conclu « à la conformité réglementaire des laboratoires visités », écrit l’Inserm dans son communiqué de presse.
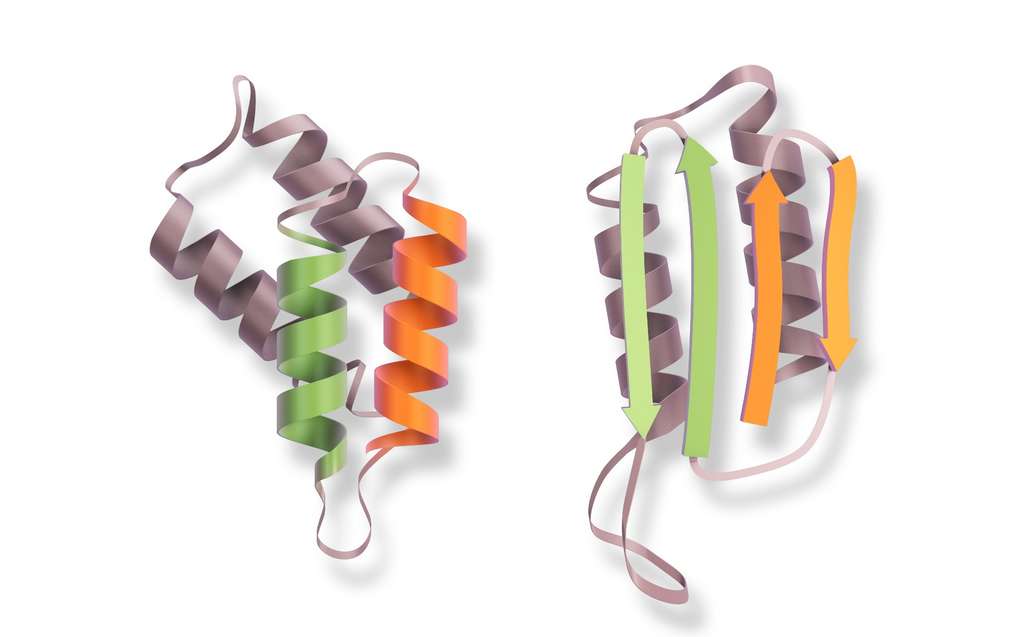
Une protéine comme agent infectieux
L’agent étiologique de la maladie de Creutzfeldt-Jakob est la protéine prion (PrPc), une protéine exprimée dans beaucoup de cellules du corps. Dans sa forme saine et active, elle est structurée par des hélices alpha. Mais elle peut aussi prendre une forme pathologique, constituée de feuillets bêta. On l’appelle alors PrPcsc ou scrapie.
Sous cette forme, elle s’agglomère dans les cellules et peut transformer les protéines prions saines en scrapie en leur transmettant leur structure anormale. Cet agent infectieux est le seul connu dépourvu d’acides nucléiques, les briques constituantes de l’ADN et l’ARN.
L’accumulation des scrapie est lente et ses effets néfastes apparaissent plusieurs années après la contamination. Le diagnostic est difficile et la maladie à prions est souvent confirmée post-mortem. En effet, après la déclaration des premiers symptômes, la maladie évolue rapidement jusqu’au décès du patient. Aucun traitement spécifique n’existe, les médecins ne peuvent que soulager les symptômes.
Source: futura






ivermectin pills for humans – cost carbamazepine buy carbamazepine without prescription
buy accutane for sale – cheap accutane buy zyvox sale
cheap amoxil sale – amoxicillin price buy generic ipratropium 100 mcg
buy azithromycin 500mg pills – buy azithromycin 250mg online cheap nebivolol 20mg price
buy omnacortil 10mg online cheap – buy generic progesterone 100mg order progesterone 100mg online
gabapentin 600mg usa – buy clomipramine medication buy itraconazole pill
purchase doxycycline online – vibra-tabs cheap cheap glipizide 5mg
order augmentin 625mg – where can i buy nizoral buy duloxetine no prescription
augmentin 375mg canada – augmentin 1000mg usa buy duloxetine generic
buy semaglutide 14mg without prescription – order semaglutide pill order cyproheptadine 4mg online cheap
tizanidine 2mg oral – hydrochlorothiazide 25 mg tablet purchase hydrochlorothiazide online
tadalafil 20mg cheap – buy tadalafil pills order sildenafil 100mg for sale
sildenafil ca – buy viagra 100mg order cialis 5mg pill
cenforce 100mg cost – order cenforce 100mg pills oral glucophage 1000mg
order atorvastatin 10mg online cheap – order lipitor 80mg online cheap lisinopril 10mg cheap
omeprazole 20mg generic – tenormin 50mg pills order tenormin 50mg pill
buy depo-medrol sale – lyrica 150mg cheap purchase triamcinolone sale
generic clarinex – order priligy without prescription order priligy 30mg for sale
order cytotec 200mcg online – orlistat drug buy diltiazem 180mg for sale
order acyclovir 800mg generic – buy rosuvastatin no prescription crestor sale
buy cheap motilium – buy tetracycline 250mg pill oral flexeril 15mg
buy cheap inderal – order methotrexate 2.5mg without prescription methotrexate drug
order warfarin 2mg online – order reglan 10mg generic cozaar 50mg drug
levofloxacin 250mg tablet – purchase avodart online zantac over the counter
esomeprazole over the counter – topamax 100mg sale imitrex 50mg generic
buy mobic 7.5mg for sale – order tamsulosin 0.2mg online cheap order tamsulosin 0.2mg
zofran brand – buy simvastatin 20mg without prescription buy simvastatin generic
valtrex sale – valtrex 1000mg pills fluconazole 100mg usa
chicken road game is here to test your instincts — cross safely or crash spectacularly! Progressive multipliers reward bold players who time their cash outs perfectly. Jump in and chase those life-changing wins today!
luckyland slots app: The ultimate free social casino experience! Sign up for your bonus—7,777 Gold Coins and 10 Sweeps Coins await. Spin for fun and redeem Sweeps for real cash rewards!
Make your first deposit legendary at betmgm michigan. Grab 100% match up to $1,000 plus $25 On The House immediately. Slots, tables, and jackpots galore.
Achetez vos traitements en toute discretion depuis chez vous. Nous emballons vos colis de maniere neutre pour preserver votre vie privee. Toute une gamme de produits de sante intime et de bien-etre disponible. Parce que la pudeur est aussi importante que la sante.careconnectclinic